
L'être humain est constitué de 60% d'eau qui se répartissent principalement dans la peau (70% du total), dans les os (20% du total) et dans nos dents (10% du total). La quantité d'eau nécessaire à un adulte est d'environ 2,5 litres par jour : une partie fournie par les aliments (environ 1 litre), l'autre fournie par les boissons (environ 1,5 litre). Les français détiennent le record du monde de la consommation d'eau en bouteille (110 litres par an). Ces eaux existent sous plusieurs formes et sous diverses appellations. Chacune d'elle correspond à un type précis d'eau.
LES EAUX DE SOURCE
Le terme "eau de source" est réservé à une eau destinée à la consommation humaine dans son état naturel, et mis en bouteille à la source, sans caractéristiques particulières quant à sa minéralisation. Leur origine est souterraine et elles sont microbiologiquement saines et protégées contre les risques de pollution. Elles sont généralement assez peu minéralisées.
LES EAUX DE MONTAGNE
Ce sont des eaux de source, soumises à l'obtention d'un agrément par arrêté préfectoral.
LES EAUX MINERALES NATURELLES
Juridiquement, on qualifie d'eau minérale naturelle une "eau provenant d'une source caractérisée par sa pureté microbiologique originelle, sa teneur en minéraux, oligo-éléments et par certains effets qu'elle produit sur l'organisme humain". La composition, la température et les autres caractéristiques essentielles de l'eau doivent demeurer stables. Les eaux minérales naturelles doivent être embouteillées sur les lieux de l'émergence et ne peuvent subir aucun traitement ni manipulation. Elles doivent être autorisées par le Ministère de la Santé ainsi que par l'Académie de Médecine.
QUALITE DE L'EAU
C'est la composition en sels minéraux qui donne à chaque eau ses propriétés. Il est donc conseillé, pour profiter pleinement des qualités des différentes eaux, de changer régulièrement d'eau.
Les eaux riches en magnésium (plus de 50 mg/l) sont utiles en périodes de stress, pour suivre un régime trop restrictif ou pour lutter contre les fatigues passagères. Le magnésium agit sur la décontraction musculaire et le système nerveux. L'apport quotidien recommandé chez l'adulte est d'environ 6 mg/kg. Ces eaux sont dites magnésiennes.
Les eaux riches en calcium (plus de 150 mg/l) aident à la croissance et sont recommandées lors d'une fracture osseuse, pour les personnes d'un certain âge, les femmes enceintes ou allaitantes. Le calcium est contenu principalement dans les os et les dents. Les besoins journaliers d'un adulte sont de 900 mg environ. Ces eaux sont dites calciques.
Les eaux riches en sodium (plus de 200 mg/l) sont bénéfiques lors d'activités intenses et de fortes chaleurs mais déconseillées aux personnes souffrant d'hypertension, de troubles cardiaques, de rétention d'eau ou bien suivant un régime sans sel. Le sodium est l'élément minéral principal du liquide extracellulaire (15 % du poids du corps humain).
Les eaux riches en bicarbonates (plus de 500 mg/l) sont intéressantes lors de digestions difficiles ou pour récupérer après un exercice physique. Les bicarbonates facilitent la digestion en contribuant à neutraliser l'acidité gastrique, mal tolérée chez certaines personnes.
Les eaux riches en potassium peuvent lutter contre la rétention d'eau car elles sont très diurétiques.
La présence de fluor dans l'eau aide l'organisme à lutter contre les caries et participe à la croissance osseuse ainsi qu'à la solidité du squelette. Cette teneur doit toujours se trouver en faible quantité ( moins de 10 mg/l) car de trop fortes doses de fluor provoquent les effets contraires de ceux escomptés.
Les eaux riches en sulfates sont généralement des eaux gazeuses. Elles ne sont pas conseillées pour les personnes souffrant des intestins ou les femmes enceintes.
Les eaux pauvres en nitrate sont le reflet d'une parfaite protection de l'eau vis-à-vis de certaines pollutions.
Les eaux faiblement minéralisées peuvent être consommées à toute occasion, notamment pour les jeunes enfants et pour la préparation des biberons. Dans ce dernier cas, elles ne doivent pas être gazeuses et avoir une teneur en nitrate inférieure à 12 mg/l. La norme admise est de 50 mg de nitrate par litre.
N'oubliez pas que l'eau, outre son action désaltérante, participe :
- à la régulation de notre température corporelle;
- au transport des molécules énergétiques, des hormones, des vitamines...
- à la communication intra-cellulaire;
- à l'élimination des déchets par les urines.
Dans le choix de l'eau, sachez lire l'étiquette. Elle doit mentionner le nom de la source et du lieu d'exploitation. Elle doit également récapituler les teneurs en sels minéraux. La première indication est ce que l'on nomme le résidu sec. Il correspond à la mesure des éléments solides qui subsistent après évaporation totale de l'élément liquide à 180 °C. Il en résulte un classement en fonction de cette valeur qui correspond à la teneur en sels minéraux :
- inférieure à 50 mg/l : eau très faiblement minéralisée
- entre 50 et 500 mg/l : eau faiblement minéralisée
- entre 500 et 1500 mg/l : eau moyennement minéralisée
- supérieure à 1500 mg/l : eau richement minéralisée
Les ions
Toutes les eaux, de par leur parcours souterrain, en contact permanent avec des roches et des argiles, se chargent de particules minérales qui proviennent des strates géologiques de la Terre. En fonction du type d'eau et du type de sol, l'eau obtenue en sortie sera plus ou moins minéralisée. Ces "morceaux" de minéraux, légèrement dénaturés car ayant subi une perte ou un gain d'électron, se retrouvent dans notre corps une fois la boisson ingérée.
Un ion est une particule électriquement chargée, responsable de la conductivité électrique dans les solutions (aqueuses, métalliques,...). On nomme anions les ions chargés électriquement et cations les ions porteurs d'une charge électrique positive. Un liquide contenant des ions est appelée une solution ionique. Sous l'effet d'un champ électrique, les ions se déplacent dans la solution, mais pas de maniére uniforme. Cela permet de mesurer la teneur globale en ions d'une solution en calculant sa conductibilité électrique.
Comme noté dans les paragraphes précédents, ces minéraux sont utiles au corps humain pour l'aider à réaliser ses actions motrices (potassium, sodium), digestives (hydrogénocarbonate), d'entretien (sulfates), structurelles (calcium, fluor)... Aprés avoir vu qu'il fallait parfois prendre garde é l'eau que nous buvons en fonction de ses caractéristiques minérales, voici détaillées les caractéristiques principales de ces ions.
- pH
- Résidus fixes
- Bicarbonates
- Calcium
- Chlorures
- Fluorures
- Magnésium
- Nitrates
- Potassium
- Sodium
- Sulfates
| Elément | valeur du pH |
|---|---|
| Acide de batterie automobile | < 1,0 |
| Acide gastrique | 2,0 |
| Jus de citron | 2,4 à 2,6 |
| Coca-Cola | 2,5 |
| Vinaigre | 2,5 à 2,9 |
| Jus d'orange | 3,5 |
| Tomate | 4,2 |
| Bière | 4,5 |
| Café | 5,0 |
| Thé | 5,5 |
| Pluies acides | < 6,0 |
| Lait | 6,5 |
| Eau pure | 7,0 |
| Salive humaine | 6,5 à 7,4 |
| Sang | 7,38 à 7,42 |
| Eau de mer | 8,0 |
| Savon | 9,0 à 10,0 |
| Ammoniaque | 11,0 |
| Chaux | 12,5 |
| 14,0 |
- pH < 7 : signale que la solution aqueuse est acide
- pH = 7 : la solution aqueuse est neutre
- pH > 7 : la solution aqueuse est basique (ou alcaline)
Les résidus fixes sont les solutés obtenus après chauffage de l'eau minérale, généralement à 25 °C. La température est importante à noter car la conductivité dépend de la température. Les résidus sont parfois appelés solutés, car ils proviennent d'un chauffage de solution aqueuse.
En fonction des sources minérales, enfin surtout de ceux qui les exploitent et vendent leur production, les étiquettes devraient toutes afficher les ions principalement trouvés dans la majorité des sources. Ce n'est pas vraiment le cas et la situation peut parfois être plus déroutante en fonction du marketing porté sur l'étiquette ou bien sur la règlementation en vigueur dans le pays d'origine.
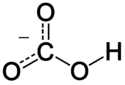 Le bicarbonate, noté normalement hydrogénocarbonate, de formule chimique HCO3-, est un ion qui
présente la caractéristique de pouvoir interagir avec des acides et des bases. C'est un ion amphotère.
Chez l'étre vivant, les ions bicarbonates jouent un rôle primordial dans la régulation du pH des liquides
physiologiques (sang et plasma).
L'hydrogénocarbonate joue le rôle de tampon dans une solution aqueuse en interagissant avec les acides et les bases
et en permettant la régulation du pH. Ce rôle de tampon est très important pour le maintien du pH sanguin (homéostasie).
Le bicarbonate, noté normalement hydrogénocarbonate, de formule chimique HCO3-, est un ion qui
présente la caractéristique de pouvoir interagir avec des acides et des bases. C'est un ion amphotère.
Chez l'étre vivant, les ions bicarbonates jouent un rôle primordial dans la régulation du pH des liquides
physiologiques (sang et plasma).
L'hydrogénocarbonate joue le rôle de tampon dans une solution aqueuse en interagissant avec les acides et les bases
et en permettant la régulation du pH. Ce rôle de tampon est très important pour le maintien du pH sanguin (homéostasie).
- < 0,05 mg / kg / jour : n'est d'aucun effet sur la prévention de la carie dentaire
- 2 mg / jour : risque de fluorose dentaire
- 10 à 40 mg / jour : fluorose du squelette
- 125 mg / jour : altération rénale
- 200 à 500 mg / jour : dose létale
- la formation des os et des dents, en conjonction avec le calcium et le phosphore
- favoriser la fixation du calcium sur les os
- transmettre l'influx nerveux
- contribuer aux mécanismes de défense immunitaire
- la bonne coordination des muscles et des contractions musculaires
- lutter contre la fatigue
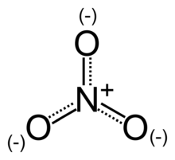 Les Nitrates, de formule chimique NO3-, sont le résultat d'une pollution du sol
par les engrais. C'est un composé d'azote et d'oxygène utile à la vie végétale, non nocif en l'état pour l'homme
en faible quantité. C'est surtout sa transformation par les enzymes du corps humain en nitrite NO2-
qui est alors un oxydant de l'hémoglobine, l'empêchant alors de jouer son rôle de transporteur d'oxygène dans
l'organisme.
La limite réglementaire de présence des nitrates dans l'eau est normalement de l'ordre de 50mg / litre pour
l'adulte et d'environ 15 mg / litre pour le nourrisson. Il est tout de même conseillé pour ces derniers de
prendre une eau ne contenant aucun nitrate.
Les Nitrates, de formule chimique NO3-, sont le résultat d'une pollution du sol
par les engrais. C'est un composé d'azote et d'oxygène utile à la vie végétale, non nocif en l'état pour l'homme
en faible quantité. C'est surtout sa transformation par les enzymes du corps humain en nitrite NO2-
qui est alors un oxydant de l'hémoglobine, l'empêchant alors de jouer son rôle de transporteur d'oxygène dans
l'organisme.
La limite réglementaire de présence des nitrates dans l'eau est normalement de l'ordre de 50mg / litre pour
l'adulte et d'environ 15 mg / litre pour le nourrisson. Il est tout de même conseillé pour ces derniers de
prendre une eau ne contenant aucun nitrate.
Références
Pour de plus amples informations, je vous conseille de consulter le dossier du site Doctissimo parlant de la composition de l'eau, des bienfaits sur l'organisme, sur le type d'eau en fonction de son âge et d'autres encore. Vous retrouverez ce dossier ICI
Un autre dossier est disponible, provenant de la revue Effervesciences. Vous le retrouverez ICI